Nefropatía membranosa: genética, antígenos y anticuerpos
Membranous nephropathy: genetics, antigens and antibodiesKaren Courville1,2,3,4
 , Norman Bustamante1,2
, Norman Bustamante1,21. Servicio de Nefrología, Hospital Dr Gustavo N Collado, Chitré, Herrera, Panamá; 2. Sociedad Panameña de Nefrología e Hipertensión, Panamá, Panamá; 3. Investigador, Instituto de Ciencias Médicas, Las Tablas, Los Santos, Panamá; 4. Sistema Nacional de Investigación SNI, SENACYT, Panamá;
Descargas
Resumen
La nefropatía membranosa es un trastorno renal caracterizado por el engrosamiento de la membrana basal glomerular, que causa el síndrome nefrótico. Puede deberse a diversas afecciones subyacentes que provocan daños en las unidades de filtración de los riñones, conocidas como nefronas, produciendo proteinuria masiva, hipoalbuminemia, edema e hiperlipidemia. Entre el 30 y el 40% de los casos de síndrome nefrótico en adultos se deben a una nefropatía membranosa.
En las últimas décadas se ha avanzado en el descubrimiento de antígenos, anticuerpos y genes implicados en la fisiopatología de la enfermedad y se ha propuesto un nuevo sistema de clasificación. La presencia de complejos antígeno-anticuerpo junto con factores genéticos puede influir en la susceptibilidad a dicha desregulación inmunológica, y establece nueva información en un lo que se conocía entre las etiologías de causas primarias y secundarias.
La comprensión de los antígenos implicados en la nefropatía membranosa es un área de investigación activa, y es posible que se identifiquen antígenos adicionales a medida que nuestro conocimiento de la enfermedad siga evolucionando. Este artículo resume algunos conceptos y hallazgos recientes sobre este tema.
La nefropatía membranosa (NM) es un trastorno renal caracterizado por el engrosamiento progresivo de la membrana basal glomerular, causante del síndrome nefrótico, que conduce a un deterioro crónico de la función renal. El síndrome nefrótico puede estar causado por diversas afecciones subyacentes que provocan daños en las unidades de filtración de los riñones, conocidas como nefronas, produciendo proteinuria masiva, hipoalbuminemia, edema e hiperlipidemia. Entre el 30 y el 40% de los casos de síndrome nefrótico en adultos se deben a nefropatía membranosa y es la principal causa de síndrome nefrótico en adultos no diabéticos [1,2].
La causa exacta de la nefropatía membranosa primaria suele ser idiopática (desconocida) en aproximadamente el 70% de los casos. Sin embargo, algunas causas secundarias y asociaciones que se han identificado incluyen enfermedades autoinmunes (lupus eritematoso sistémico); enfermedad tiroidea autoinmune; infecciones como hepatitis B o C; medicamentos como antiinflamatorios no esteroideos, penicilamina; neoplasias malignas como tumores sólidos y neoplasias hematológicas y otras como se describe en la Tabla 1.

En ambos casos, la presencia de inmunoglobina y de depósitos inmunitarios que contienen complejos antígeno-anticuerpo entre la membrana basal glomerular y los podocitos son responsables del daño podocitario [5]. Los desencadenantes exactos de la respuesta inmunitaria que conduce a la formación de estos complejos no se conocen del todo, pero los factores genéticos pueden influir en la susceptibilidad a dicha desregulación inmunitaria.
Factores genéticos
Los individuos con antecedentes familiares de enfermedad renal, incluida la NM, pueden tener un mayor riesgo de desarrollar la afección, lo que indica una predisposición genética. Se han implicado varios factores genéticos en el desarrollo de la nefropatía membranosa, y las mutaciones o variaciones en estos genes pueden contribuir a la respuesta inmunitaria anormal y a la formación de complejos inmunitarios en los glomérulos, lo que provoca inflamación y daños [6].
Genes asociados
Los hallazgos de los estudios de asociación de genoma completo explican cómo autoantígenos como PLA2R desencadenan una respuesta autoinmune [7]. Los informes de un grupo de estudio de 3 cohortes de un total de 556 pacientes de ascendencia blanca europea con diagnóstico de nefropatía membranosa idiopática y 2.338 controles [8], identificaron el alelo HLA-DQA1 en el cromosoma 6 que podría facilitar el desarrollo de autoanticuerpos dirigidos no sólo contra PLA2R1 sino también contra otros antígenos. Los hallazgos sugieren que el desencadenante podría ser una interacción entre variantes genéticas de proteínas del sistema inmunitario y componentes glomerulares. HLA-DQA1 es un gen HLA de clase II que forma parte de un heterodímero compuesto por una cadena alfa (DQA) y una cadena beta (DQB), ambas ancladas en la membrana y formando el surco presentador de antígenos. Las variantes de secuencia en la cadena HLA-DQA1 contienen polimorfismos que determinan las especificidades de unión a péptidos. Si se produce una alteración en la forma del surco peptídico, podría por tanto cambiar su conformación, alterar la presentación del inmunógeno o la secuencia de aminoácidos [9,10].
En este momento, las pruebas sugieren que PLA2R1 es el objetivo más importante en la actualidad, y se cree que atacarlo con autoanticuerpos es un mecanismo importante en el desarrollo de la MN. Hay algunas pruebas que sugieren un posible papel de otros genes en la patogénesis de la MN, como NFKB1, IRF4, que podrían ser indirectos o estar implicados en vías específicas relacionadas con el desarrollo de la MN. Sin embargo, las pruebas no son tan sólidas como en el caso de PLA2R1. [15].
SNPs and NM
Hubo una asociación significativa de MN con una variación de un solo nucleótido en el locus HLA-DQA1 de clase II rs2187668 y rs4664308 de PLA2R1, donde los pacientes con estos alelos de riesgo tenían un riesgo 11,13 veces mayor de MN. Los pacientes con homocigosis rs9272729 de HLA-DQA1 y heterocigosis rs17830558 de PLA2R tenían un riesgo 80 veces mayor de desarrollar NM. También se estudió el HLA-DRB1 y los alelos de riesgo encontrados fueron DRB1*1501 y DRB1*0301, también genes HLA de clase II, ambos con un mayor riesgo de desarrollar MN, ORs de 4,65 y 3,96 respectivamente [11,12].
Factores ambientales
Aunque los factores genéticos desempeñan un papel, los desencadenantes ambientales también contribuyen al desarrollo de la nefropatía membranosa. Las infecciones, los medicamentos (antiinflamatorios no esteroideos y ciertos antibióticos) y la exposición a determinadas toxinas se han identificado como posibles factores ambientales que pueden inducir o exacerbar la afección, como se ha informado en diversos estudios realizados en China, de casos de MN en zonas urbanas, con pacientes expuestos a la contaminación ambiental, presentan mediciones de niveles elevados de citoquinas Th17 debido a la exposición a partículas contaminantes en el aire (partículas finas de 2. 5 micrómetros o menos de diámetro conocidas como Partículas 2.5 o PM2.5, producidas por combustión, polvo o humo) pueden alterar la expresión de microARN, promoviendo así la exposición de autoantígenos PMN [13,14].
Antígenos y anticuerpos
En la MN la fisiopatología implica la formación de complejos inmunes dentro de la membrana basal glomerular, que consisten en anticuerpos y antígenos. Estos complejos antígeno-anticuerpo activan el sistema del complemento, generan el complejo de ataque de membrana C5b-C9, liberando citoquinas, oxidantes, proteasas y desorganizando la estructura de los podocitos y depositándose entre la membrana basal glomerular, aumentando la matriz extracelular, lo que conduce a la inflamación y daño de los glomérulos [16,17]. Los podocitos son células diferenciadas con una capacidad regenerativa limitada y, tras el daño, aumenta la permeabilidad a la albúmina. La exposición prolongada a la albúmina provoca una respuesta inflamatoria e induce la muerte celular de los podocitos por apoptosis [18].
Biomarcadores potenciales
En 2009 se descubrió el PLA2R, receptor de fosfolipasa A2 de tipo M, y su anticuerpo. PLA2R es una glicoproteína transmembrana que se expresa en la superficie de los podocitos y es el principal antígeno de la enfermedad en la MN primaria [19, 20].
Desde entonces y gracias a las nuevas tecnologías en tejido de biopsia renal, microdisección láser y espectrometría de masas, se han descubierto otra serie de antígenos diana, tanto para MN primaria como secundaria. Algunos de estos antígenos tienen enfermedades clínicas identificadas, como se describe en la tabla 2.
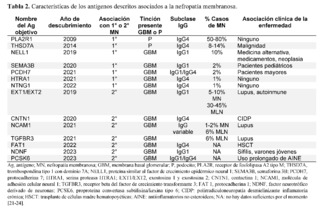
El concepto de identificación de un antígeno en la MN es que se acumula o deposita en el glomérulo y este antígeno es diferente y único para cada caso. Mediante inmunohistoquímica o inmunofluorescencia se pueden evidenciar depósitos subepiteliales en las paredes de los capilares de los glomérulos. Estos antígenos producen anticuerpos circulantes, que pueden medirse en sangre mediante técnicas de Western blot y confirmarse así. Todavía no es fácil medir cada uno de estos antígenos en sangre en todos los centros, pero esto abre una ventana de oportunidades para su identificación en la clínica, y en el futuro, utilizando la biopsia renal para aquellos casos que no puedan ser identificados mediante estas pruebas [25].
Para que un anticuerpo sea detectado en la sangre, se requiere que haya una cantidad suficiente en la circulación, lo que significa que ya habría un daño significativo en los podocitos, que permitirá el pasaje de albúmina, con la consecuente aparición de proteinuria y presencia de edema [26,27]. En algunos centros se dispone de pruebas para la búsqueda de anticuerpos Anti-PLA2R en muestras de sangre de pacientes, mediante técnicas de inmunofluorescencia y ELISA [28].
Es importante señalar que en algunos casos de MN, ni los anticuerpos anti-PLA2R o anti-THSD7A, ni otros antígenos pueden ser detectables, y la causa de la enfermedad puede ser secundaria a otras afecciones subyacentes, como infecciones, enfermedades autoinmunes o medicamentos. En estos casos, los antígenos derivados de enfermedades infecciosas, autoinmunes, del entorno o de medicamentos, o el complejo inmunitario circulante viajan hasta el glomérulo y se localizan en el espacio subepitelial. Además, los antígenos tumorales pueden producir una respuesta inmune humoral que, en consecuencia, puede dar lugar a una MN secundaria [29,30]. En un futuro próximo, algunas otras técnicas, como las pruebas de ADN libre de células (cfADN), también conocidas como biopsia líquida, un enfoque diagnóstico no invasivo que consiste en analizar fragmentos de ADN que circulan libremente por el torrente sanguíneo, podrían ser útiles para identificar enfermedades autoinmunes como la nefropatía membranosa, ya que también se han mostrado prometedoras en la identificación de enfermedades autoinmunes, como el lupus eritematoso sistémico [31].
Anteriormente, la clasificación de la NM establecía la diferencia entre causas primarias y secundarias. Ante el descubrimiento de estos nuevos antígenos y las asociaciones con genes específicos implicados en la fisiopatología de la NM, los expertos recomiendan que se promueva una nueva clasificación (Mayo Clinic consensus report on membranous nephropathy: proposal for a novel classification) [32], basada en los antígenos específicos y en si existe una asociación con la enfermedad o el uso de medicamentos establecida.
El descubrimiento de estos nuevos antígenos y sus correspondientes anticuerpos permite el desarrollo de pruebas diagnósticas en suero que podrían en algún momento reducir la necesidad de biopsias renales y monitorizar la eficacia del tratamiento o la evolución de la enfermedad en términos de remisión. Aunque el anti-PLA2R1 sigue siendo la diana más establecida en el diagnóstico de la MN, la exploración de otros antígenos como NELL, THSD7A y otros es prometedora para mejorar la precisión diagnóstica. La comprensión de los antígenos implicados en la MN es un área de investigación activa, y es posible que se identifiquen antígenos adicionales a medida que nuestro conocimiento de la enfermedad siga evolucionando.
Citas
[1] Alsharhan L, Beck LH Jr. Membranous Nephropathy: Core Curriculum 2021. Am J Kidney Dis. 2021;77(3):440-453. https://doi:10.1053/j.ajkd.2020.10.009
[2] Alok A, Yadav A. Membranous Nephropathy. In: StatPearls. Treasure Island (FL): StatPearls Publishing; June 5, 2023. PMID: 32644595 Bookshelf ID: NBK559169 https://www.ncbi.nlm.nih.gov/books/NBK559169/
[3] Ronco P, Debiec H. Molecular Pathogenesis of Membranous Nephropathy. Annu Rev Pathol. 2020; 15:287-313. https://doi:10.1146/annurev-pathol-020117-043811
[4] Couser WG. Primary Membranous Nephropathy. Clin J Am Soc Nephrol. 2017 Jun 7;12(6):983-997. https://doi:10.2215/CJN.11761116
[5] Liu W, Gao C, Dai H, et al. Immunological Pathogenesis of Membranous Nephropathy: Focus on PLA2R1 and Its Role. Front Immunol. 2019; 10:1809. https://doi:10.3389/fimmu.2019.01809
[6] Sekula P, Li Y, Stanescu HC, et al. Genetic risk variants for membranous nephropathy: extension of and association with other chronic kidney disease aetiologies. Nephrol Dial Transplant. 2017;32(2):325-332. https://doi:10.1093/ndt/gfw001
[7] Chung EYM, Wang YM, Keung K, et al. Membranous nephropathy: Clearer pathology and mechanisms identify potential strategies for treatment. Front Immunol. 2022; 13:1036249. Published 2022 Nov 2. https://doi:10.3389/fimmu.2022.1036249
[8] Stanescu HC, Arcos-Burgos M, Medlar A, et al. Risk HLA-DQA1 and PLA(2)R1 alleles in idiopathic membranous nephropathy. N Engl J Med. 2011; 364(7):616-626. https://doi.org/10.1056/NEJMoa1009742.
[9] Cui Z, Xie LJ, Chen FJ, et al. MHC Class II Risk Alleles and Amino Acid Residues in Idiopathic Membranous Nephropathy. J Am Soc Nephrol. 2017; 28(5):1651-1664. https://doi:10.1681/ASN.2016020114
[10] Le WB, Shi JS, Zhang T, et al. HLA-DRB1*15:01 and HLA-DRB3*02:02 in PLA2R-Related Membranous Nephropathy. J Am Soc Nephrol. 2017; 28(5):1642-1650. https://doi:10.1681/ASN.2016060644
[11] Gu Y, Xu H, Tang D. Mechanisms of Primary Membranous Nephropathy. Biomolecules. 2021; 11(4):513. https://doi.org/10.3390/biom11040513
[12] Gupta S, Köttgen A, Hoxha E, et al. Genetics of membranous nephropathy. Nephrol Dial Transplant. 2018;33(9):1493-1502. https://doi:10.1093/ndt/gfx296
[13] Cremoni M, Brglez V, Perez S, et al. Th17-Immune Response in Patients With Membranous Nephropathy Is Associated With Thrombosis and Relapses. Front Immunol. 2020; 11:574997. Published 2020 Nov 26. https://doi:10.3389/fimmu.2020.574997
[14] Xu X, Wang G, Chen N, et al. Long-Term Exposure to Air Pollution and Increased Risk of Membranous Nephropathy in China. J Am Soc Nephrol. 2016; 27(12):3739-3746. https://doi:10.1681/ASN.2016010093
[15] Xie J, Liu L, Mladkova N, et al. The genetic architecture of membranous nephropathy and its potential to improve non-invasive diagnosis. Nat Commun. 2020;11(1):1600. Published 2020 Mar 30. https://doi:10.1038/s41467-020-15383-w
[16] Nangaku M, Shankland SJ, Couser WG. Cellular response to injury in membranous nephropathy. J Am Soc Nephrol. 2005;16(5):1195-1204. https://doi:10.1681/ASN.2004121098
[17] Kon SP, Coupes B, Short CD, et al. Urinary C5b-9 excretion and clinical course in idiopathic human membranous nephropathy. Kidney Int. 1995; 48(6):1953-1958. https://doi:10.1038/ki.1995.496
[18] Okamura K, Dummer P, Kopp J, et al. Endocytosis of albumin by podocytes elicits an inflammatory response and induces apoptotic cell death. PLoS One. 2013; 8(1): e54817. https://doi:10.1371/journal.pone.0054817
[19] Beck LH Jr, Bonegio RG, Lambeau G, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med. 2009; 361(1):11-21. https://doi:10.1056/NEJMoa0810457
[20] Nayer A, Asif A. Idiopathic membranous nephropathy and anti-phospholipase A2 receptor antibodies. J Nephropathol. 2013; 2(4):214-216. https://doi:10.12860/JNP.2013.35
[21] Ahmad SB, Appel GB. Antigens, antibodies, and membranous nephropathy: a decade of progress. Kidney Int. 2020;97(1):29-31. https://doi:10.1016/j.kint.2019.10.009
[22] Beck LH Jr. PLA2R and THSD7A: Disparate Paths to the Same Disease? J Am Soc Nephrol. 2017;28(9):2579-2589. https://doi:10.1681/ASN.2017020178
[23] Sethi A, Miao J, Willrich MAV, et al. Limited Significance of Antifactor H Antibodies in Patients with Membranous Nephropathy. Clin J Am Soc Nephrol. 2021;16(6):939-941. https://doi:10.2215/CJN.16631020
[24] Tomas NM, Beck LH Jr, Meyer-Schwesinger C, et al. Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy. N Engl J Med. 2014;371(24):2277-2287. https://doi:10.1056/NEJMoa1409354
[25] Ronco P, Beck L, Debiec H, et al. Membranous nephropathy. Nat Rev Dis Primers. 2021;7(1):69. Published 2021 Sep 30. https://doi:10.1038/s41572-021-00303-z
[26] Beck LH Jr, Fervenza FC, Beck DM, et al. Rituximab-induced depletion of anti-PLA2R autoantibodies predicts response in membranous nephropathy. J Am Soc Nephrol. 2011;22(8):1543-1550. https://doi:10.1681/ASN.2010111125
[27] De Vriese AS, Glassock RJ, Nath KA, Sethi S, Fervenza FC. A Proposal for a Serology-Based Approach to Membranous Nephropathy. J Am Soc Nephrol. 2017;28(2):421-430. https://doi:10.1681/ASN.2016070776
[28] Liu YC, Chun J. Prospects for Precision Medicine in Glomerulonephritis Treatment. Can J Kidney Health Dis. 2018;9(5):2054358117753617. https://:doi:10.1177/2054358117753617
[29] Vivarelli M, Emma F, Pellé T, et al. Genetic homogeneity but IgG subclass-dependent clinical variability of alloimmune membranous nephropathy with anti-neutral endopeptidase antibodies. Kidney Int. 2015;87(3):602-609. https://doi:10.1038/ki.2014.381
[30] Hoxha E, Wiech T, Stahl PR, et al. A Mechanism for Cancer-Associated Membranous Nephropathy. N Engl J Med. 2016;374(20):1995-1996. https://doi:10.1056/NEJMc1511702
[31] Zhang S, Lu X, Shu X, et al. Elevated plasma cfDNA may be associated with active lupus nephritis and partially attributed to abnormal regulation of neutrophil extracellular traps (NETs) in patients with systemic lupus erythematosus. Intern Med. 2014;53(24):2763-2771. https://doi:10.2169/internalmedicine.53.2570
[32] Sethi S, Beck LH Jr, Glassock RJ, et al. Mayo Clinic consensus report on membranous nephropathy: proposal for a novel classification. Kidney Int. 2023;104(6):1092-1102. https://doi:10.1016/j.kint.2023.06.032

